Chưa có sản phẩm trong giỏ hàng.
Tin tức, Công nghệ & sản phẩm mới, Khoa học và đời sống
Tán xạ tia X góc nhỏ giúp xác định đặc tính của liposome trong các ứng dụng dược phẩm
Tán xạ tia X góc nhỏ (SAXS) là một công cụ vô giá để phân tích liposome. Liposome là một loại hạt nano được đặc trưng bởi lớp lipid kép của chúng. Tính linh hoạt, dễ sản xuất và tính tương thích sinh học của chúng làm cho chúng trở thành chất mang hấp dẫn đối với các thành phần hoạt tính trong các ứng dụng dược phẩm, mỹ phẩm và thực phẩm. Do đó, liposome là một trong số ít các loại hệ thống phân phối thuốc nano. SAXS là một công cụ hiệu quả để thăm dò kích thước và hình dạng cũng như tính linh hoạt của màng (membrane) và sự kết hợp của các thành phần hoạt tính vào trong màng. Hơn nữa, SAXS cung cấp các kết quả có liên quan về mặt thống kê và một số hiểu biết độc đáo về liposome mà các kỹ thuật khác không thể tiếp cận được.
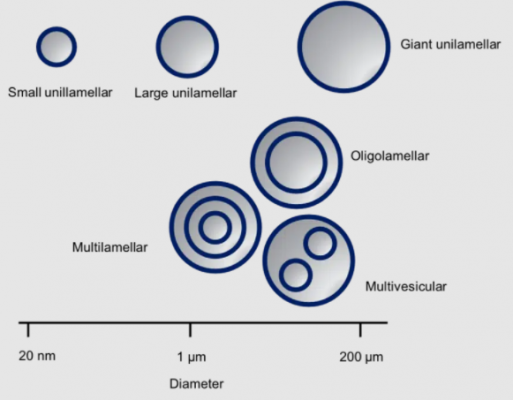
Liposome, được mô tả lần đầu tiên vào đầu những năm 60, là những túi hình cầu (spherical vesicles) với hai lớp lipid chủ yếu bao gồm các phospholipid. Kích thước của chúng thay đổi từ hàng chục nanomet đến hơn 200 micromet. Có hai loại liposome: unilamellar (1 lớp kép) và multilamellar (đa lớp kép). Các túi (nang) đa lớp (Multilamellar vesicles) còn được phân loại thành các liposome đa lớp (Multilamellar), oligolamellar (chứa 2-5 lớp kép lipid đồng tâm) và liposome chứa liposome – đa túi (multivesicular liposomes) (xem hình sau). Tính tương đối dễ sản xuất và khả năng tương thích sinh học của chúng khiến chúng trở thành chất mang lý tưởng cho các thành phần dược phẩm hoạt tính (API) cũng như trong các công thức mỹ phẩm và thực phẩm. [2]
Ngoài các loại phospholipid khác nhau, liposome thường chứa cholesterol hoặc các phân tử ưa lipid khác. Hơn nữa, bề mặt có thể được biến tính bằng polyethylene glycol (PEG) hoặc các polyme khác, protein, phân tử nhỏ, carbohydrate và các chất khác để điều chỉnh tính ổn định, khả năng hòa tan của chúng hoặc hướng chúng đến các mô nơi chúng sẽ giải phóng chất hoạt tính bên trong ra. Tính linh hoạt này đã dẫn đến thành công của liposome như là hệ thống phân phối thuốc nano, mà được minh họa rõ nhất bằng các liposome hiện đang có mặt trên thị trường trong các công thức đã được thử nghiệm lâm sàng. [I]
Một số ví dụ về các công thức được thương mại hoá thành công là Doxil®, LMX-4® và DepoDur®. Điểm chung của các loại thuốc đã đăng ký này là thành phần hoạt tính quá dễ tan để được sử dụng trực tiếp. Do đó, chúng được bao bọc trong chất mang liposome.
Đặc trưng độ dày lớp màng và lớp lipid kép với SAXS
Để bảo vệ sức khỏe của người tiêu dùng và duy trì chất lượng ổn định, việc sản xuất liposome cho các ứng dụng này được quy định theo hướng dẫn Thực hành Sản xuất Tốt (GMP). Các hướng dẫn này nêu rõ rằng các quy trình sản xuất phải được xác định và kiểm soát rõ ràng, và bất kỳ thay đổi nào trong quy trình đều phải được đánh giá. [ii] Phân tích hình thái học là một phần quan trọng của việc kiểm soát chất lượng và Tán xạ tia X góc nhỏ là một phương pháp phù hợp công cụ này.
Số lượng lớp kép lipid là một trong những thông số mà FDA (Cơ quan Quản lý Thực phẩm và Dược phẩm) đánh giá là quan trọng. Số lượng lớp kép lipid là yếu tố chủ yếu trong khả năng chứa và giữ dược chất của liposome. [iii] Có thể dễ dàng xác định chính xác số lượng lớp kép lipid và hình dạng của chúng với SAXS. Kết hợp phép đo với Tán xạ tia X góc rộng (WAXS), có thể thu được thông tin về khoảng cách chuỗi Alkyl. Điều này cho phép xác định các pha của gel, lipid hay ripple.
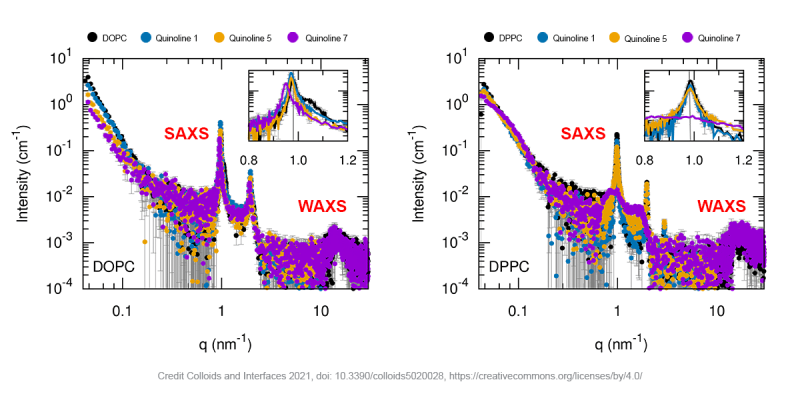
Ví dụ, trong một công bố gần đây của các nhà khoa học từ Đại học Universita degli Studi dell Aquila và Đại học La Sapienza ở Ý, SAXS đã được sử dụng cùng với các phương pháp mô tả đặc tính khác để nghiên cứu sự nạp Quinoline vào trong các liposome bao gồm các lipid khác nhau [3]. Quinoline là một hợp chất nổi tiếng và đa năng, tuy nhiên với độ hòa tan thấp, hạn chế tác động của nó đối với các ứng dụng dược lý có thể được khắc phục bằng cách đưa nó vào liposome. Hình dưới đây cho thấy các phép đo SAXS và WAXS của các túi đa lớp (multilamellar vesicles) chứa quinoline với các công thức quinoline khác nhau và các liposome được tạo thành từ các phospholipid khác nhau (DOPC, DPPC). Các đỉnh tán xạ được xác định rõ ràng xác nhận sự hiện diện của các túi với số lượng lớp kép lipid mong muốn. Liposome DPPC được nạp với quinoline [7] là một ngoại lệ. Ở đây, các đỉnh tán xạ rộng gợi ý sự hiện diện của các liposome với số lượng các lớp kép xếp chồng lên nhau ít hơn nhiều.
Hơn nữa, SAXS là kỹ thuật được lựa chọn để mô tả cho độ dày lớp kép do độ phân giải nanomet của nó và vì nó cung cấp thông tin có liên quan về mặt thống kê từ một thể tích mẫu cỡ 1 milimet khối. SAXS cũng cung cấp cái nhìn sâu sắc về tính linh hoạt của màng và sự kết hợp của các thành phần hoạt tính. [1,2] Ngược lại với nhiều kỹ thuật khác, chẳng hạn như Kính hiển vi điện tử lạnh (CryoEM), các mẫu có thể được đo ở trạng thái gần nguyên bản nhất, thể hiện chính xác trạng thái nguyên bản và tạo điều kiện thuận lợi cho việc đo các mẫu khó đông lạnh. [4] Điều quan trọng, SAXS cho phép kiểm tra các thông số được đề cập ở trên như một hàm của nhiệt độ và các thông số môi trường khác. [1,2, 4-7]
Trong một số trường hợp, SAXS có thêm lợi thế, ví dụ như hiện nay nó là phương pháp trực tiếp duy nhất để đo kích thước và cấu trúc của các “vương miện-coronas” PEG của liposome vì nó không đủ độ tương phản đối với các kỹ thuật khác như cryo-TEM. [8-9]
SAXS mô tả kích thước liposome
Ngoài các nghiên cứu về hình thái đa lớp, SAXS có thể được sử dụng để xác định đặc điểm kích thước của liposome trong phạm vi từ vài nanomet đến vài trăm nanomet, tùy thuộc vào loại liposome và thiết bị. Trong một công bố gần đây của Viện Công nghệ Karlsruhe (KIT) [10], SAXS đã được sử dụng để nghiên cứu việc sử dụng liposome như một cách thức ổn định fluorocarbons trong nhũ tương. Trong nghiên cứu cơ bản này, các phospholipid với nhiều kích thước đầu, độ dài chuỗi và nồng độ khác nhau của phospholipid đã được khảo sát. Thứ nhất, SAXS xác nhận rõ ràng sự hình thành liposome, trong khi điều này không rõ ràng đối với các mẫu mới được chuẩn bị từ các kỹ thuật đo lường khác. Thứ hai, SAXS không nhạy với các bọt khí trong các mẫu trong quá trình sản xuất. Do đó, SAXS có thể cung cấp một thước đo đáng tin cậy hơn cho kích thước của liposome hơn là kích thước thủy động lực học trung bình có trọng số cường độ được đo bằng quang phổ tương quan photon (Photon Correlated Spectroscopy-PCS). Trong trường hợp cụ thể này, phép đo PCS còn bị cản trở bởi sự khác biệt nhỏ trong chiết suất của cả hai pha, đây không phải là vấn đề đối với SAXS vì độ tương phản phụ thuộc vào sự khác biệt về mật độ điện tử chứ không phải chỉ số khúc xạ.
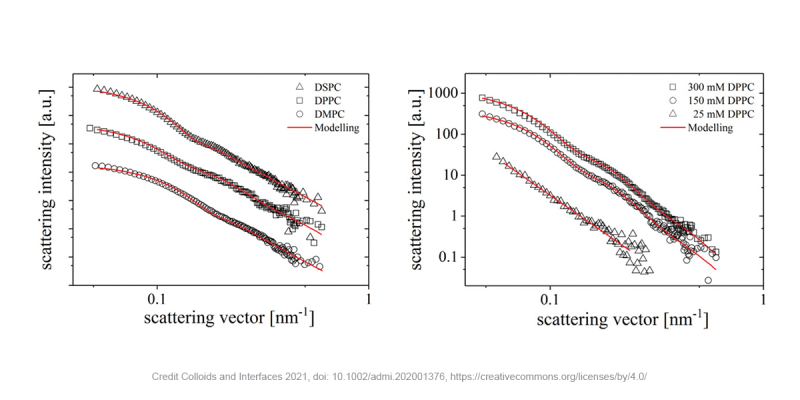
Như có thể thấy trong các biểu đồ bên dưới, các dạng tán xạ trung bình xuyên tâm của các liposome với các phospholipid khác nhau (trái) và ở các nồng độ khác nhau (phải) có thể được mô hình hóa với độ fit cao. Kết quả chỉ ra rằng kích thước của liposome tăng lên khi chiều dài đuôi phospholipid tăng từ 48 nm đối với DMPC lên 59 nm đối với DSPC và 61 nm đối với DPPC. Thay đổi nồng độ DPPC từ 25 đến 300 mM dẫn đến sự hình thành liposome từ 61 nm vượt quá giới hạn phát hiện của thiết bị. Hơn nữa, sự gia tăng cường độ tán xạ dẫn đến kết luận rằng càng có nhiều phospholipid thì càng có nhiều liposome được hình thành.
Những kết quả này cho thấy bước đầu tiên quan trọng trong việc phát triển nhũ tương fluorocarbon trong nước có thể được sử dụng cho mục đích dược phẩm. Fluorocarbon gần đây đã được quan tâm như là chất mang cho các loại thuốc kỵ nước cũng như oxy dạng khí nén. Hơn nữa, fluorocarbon được sử dụng làm chất tương phản trong MRI. Cho đến nay, quy trình sản xuất vẫn chưa tối ưu, mặc dù lãng phí rất nhiều thành phần hoạt tính – một vấn đề có thể được giải quyết với việc sử dụng liposome.
Các giải pháp SAXS của Xenocs cho nghiên cứu & phát triển và sản xuất chất vận chuyển thuốc
Liposome, trong số nhiều loại hạt nano khác, là chất mang hấp dẫn để phân phối thuốc, cung cấp khả năng vô tận để giải quyết các nhu cầu dược phẩm khác nhau. Xenocs cung cấp các giải pháp cho sự phát triển liposome và các hạt nano khác một cách hiệu quả nhất. Các sản phẩm của Xenocs rút ngắn các giai đoạn R&D bằng cách cung cấp các kết quả mạnh mẽ và đáng tin cậy. Hơn nữa, chúng rất phù hợp để giám sát sản xuất và kiểm soát chất lượng. Điều này giúp đảm bảo rằng các sản phẩm an toàn tiếp cận thị trường nhanh hơn.
Nguyễn Tiến Dũng tổng hợp và dịch.
Nguồn: Xenocs.com
- Sách trắng – Ứng dụng kỹ thuật Tán xạ tia X góc nhỏ (SAXS) để nghiên cứu, phát triển và bào chế thuốc
- Tìm hiểu thêm thiết bị tán xạ tia X được sử dụng cho ứng dụng trên tại đây!
- Cập nhật những tin tức KHCN & Đời sống mới nổi bật trên thế giới sử dụng kỹ thuật tán xạ tia X góc nhỏ
Một số tin tức KHCN liên quan:
- Lựa chọn, phân tích đặc tính sinh-lý và cấu trúc kháng thể nano tổng hợp giúp vô hiệu hoá hiệu quả vi rút Sars-coV-2
- Tia X có thể giúp test nhanh COVID-19 tin cậy và nhanh chóng hơn trở thành hiện thực như thế nào
- Thiết bị tia X mới tại KU Food kiểm tra bít tết thực vật trong quá trình chiên
- Tìm hiểu thực phẩm ở cấp độ phân tử bằng tia X để tạo ra Snack ngon hơn bao giờ hết trong tương lai
- Tia X sẽ tạo ra chế độ ăn dựa trên thực vật trong tương lai ngon hơn
Tài liệu tham khảo và đọc thêm:
- Sreij, R.; Dargel, C.; Moleiro, L. H.; Monroy, F.; Hellweg, T. Aescin Incorporation and Nanodomain Formation in DMPC Model Membranes. Langmuir 2017, 33 (43), 12351–12361. https://doi.org/10.1021/acs.langmuir.7b02933.
- Chaves, M. A.; Oseliero Filho, P. L.; Jange, C. G.; Sinigaglia-Coimbra, R.; Oliveira, C. L. P.; Pinho, S. C. Structural Characterization of Multilamellar Liposomes Coencapsulating Curcumin and Vitamin D3. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2018, 549, 112–121. https://doi.org/10.1016/j.colsurfa.2018.04.018.
- Battista, S.; Marsicano, V.; Arcadi, A.; Galantini, L.; Aschi, M.; Allegritti, E.; Del Giudice, A.; Giansanti, L. UV Properties and Loading into Liposomes of Quinoline Derivatives. Colloids and Interfaces 2021, 5 (2), 28. https://doi.org/10.3390/colloids5020028.
- Borro, B. C.; Toussaint, M. S.; Bucciarelli, S.; Malmsten, M. Effects of Charge Contrast and Composition on Microgel Formation and Interactions with Bacteria-Mimicking Liposomes. Biochimica et Biophysica Acta (BBA) – General Subjects 2021, 1865 (4), 129485. https://doi.org/10.1016/j.bbagen.2019.129485.
- Lim, S. W. Z.; Wong, Y. S.; Czarny, B.; Venkatraman, S. Microfluidic-Directed Self-Assembly of Liposomes: Role of Interdigitation. Journal of Colloid and Interface Science 2020, 578, 47–57. https://doi.org/10.1016/j.jcis.2020.05.114.
- Wood, I.; Albano, J. M. R.; Filho, P. L. O.; Couto, V. M.; de Farias, M. A.; Portugal, R. V.; de Paula, E.; Oliveira, C. L. P.; Pickholz, M. A Sumatriptan Coarse-Grained Model to Explore Different Environments: Interplay with Experimental Techniques. Eur Biophys J 2018, 47 (5), 561–571. https://doi.org/10.1007/s00249-018-1278-2.
- BioXolver application note ANBX06 Probing the effect of oxidation on model lipid bilayers.
- Schilt, Y.; Berman, T.; Wei, X.; Barenholz, Y.; Raviv, U. Using Solution X-Ray Scattering to Determine the High-Resolution Structure and Morphology of PEGylated Liposomal Doxorubicin Nanodrugs. Biochim Biophys Acta 2016, 1860 (1 Pt A), 108–119. https://doi.org/10.1016/j.bbagen.2015.09.012.
- Nordström, R.; Zhu, L.; Härmark, J.; Levi-Kalisman, Y.; Koren, E.; Barenholz, Y.; Levinton, G.; Shamrakov, D. Quantitative Cryo-TEM Reveals New Structural Details of Doxil-Like PEGylated Liposomal Doxorubicin Formulation. Pharmaceutics 2021, 13 (1), 123. https://doi.org/10.3390/pharmaceutics13010123.
- Ullmann, K.; Meier, M.; Benner, C.; Leneweit, G.; Nirschl, H. Water-in-Fluorocarbon Nanoemulsions Stabilized by Phospholipids and Characterized for Pharmaceutical Applications. Advanced Materials Interfaces 2021, 8 (1), 2001376. https://doi.org/10.1002/admi.202001376.
[i] https://dx.doi.org/10.3390%2Fpharmaceutics9020012
[ii] https://ec.europa.eu/health/documents/eudralex/vol-4_en
[iii]http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm070570.pdf