Mô tả chi tiết về mặt lý-sinh của các tương tác giữa kháng thể với protein kháng nguyên là rất quan trọng để hướng dẫn mô tả đặc tính vật lý và kỹ thuật phân tử của các mục tiêu trị liệu. Protein có thể trải qua những thay đổi về cấu trúc hoặc sự sắp xếp lại cấu trúc khi liên kết với ligand. Tinh thể học tia X và phổ cộng hưởng từ hạt nhân (NMR) được sử dụng để xác định cấu trúc nguyên tử của phức hệ protein-protein và protein-ligand ở trạng thái ổn định. Tuy nhiên, các kỹ thuật này bị hạn chế bởi quá trình glycosyl hóa nặng, tính linh hoạt, độ ổn định và kích thước của phức hệ. Tán xạ tia X góc nhỏ (SAXS) có thể được sử dụng để định lượng các thay đổi cấu trúc hoặc sự sắp xếp lại cấu trúc khi ligand (các protein khác, DNA / RNA, carbohydrate và các hợp chất nhỏ) liên kết trong dung dịch [1,2]. SAXS cung cấp kiến thức về trạng thái cân bằng, mối quan hệ định lượng hay tỷ lệ khi thay đổi vật lý hoặc thay đổi hóa học (stoichiometry) của liên kết, liên hợp và quá trình phân ly trong điều kiện gần sinh lý.
Castellanos và cộng sự. [2] đã sử dụng SAXS và sắc ký loại trừ kích thước (SEC) kết hợp với mô hình phân tử để nghiên cứu sự tương tác của kháng thể đơn dòng kháng streptavidin (ASA-IgG2) với tetrameric streptavidin (tSA). Các phép đo SAXS được thực hiện trực tiếp trên các dung dịch phức hệ số lượng lớn (không phân đoạn), trên các phần nhỏ được thu thập sau SEC (phân tách phức hệ) hoặc trong các phép đo tại chỗ (In-Situ) kết hợp với SEC-SAXS.
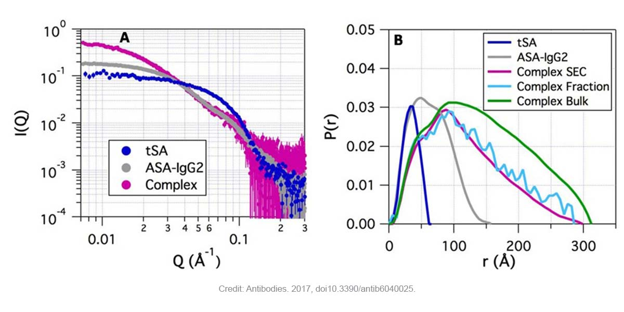
Hình 1 chứng minh rằng: (A) phức hệ ASA-IgG2-tSA thể hiện cường độ cao hơn ở các giá trị Q thấp (tỷ lệ với trọng lượng phân tử) so với các thành phần tự do và (B) phức hệ chính hiển thị giá trị Dmax dài hơn ( bất kể các phương pháp phân tách được sử dụng SEC, Fraction hoặc Bulk) hơn hai thành phần. Hơn nữa, phép tính tỷ lệ (stoichiometry) từ thí nghiệm SEC-SAXS chỉ ra rằng các phức hệ với hai phân tử ASA-IgG2 và hai tSA là thành cơ bản trong cấu tử chính [2].
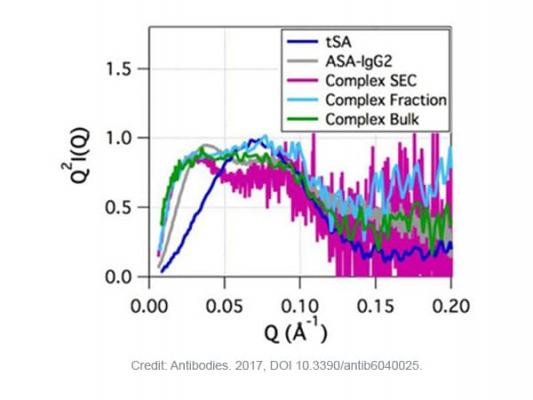
Biểu đồ Kratky (Q2I(Q) so với Q) là một biểu diễn hữu ích để đánh giá định tính tính linh hoạt và trạng thái gấp của protein và hệ protein-ligand. Nó cung cấp một thước đo để đánh giá những thay đổi trong trạng thái cấu trúc / độ gấp của hệ khi liên kết với ligand. Các protein gấp lại thể hiện bởi các đường cong parabol, trong khi các protein không gấp thể hiện ở các đường cong hypebol.
Hình 2 cho thấy một đường cong parabol (hình chuông, đặc trưng của protein hình cầu) cho tSA và một đường cong không phải parabol (non-parabol) cho ASA-IgG2 do tính linh hoạt vốn có đã được báo cáo đối với các kháng thể đơn dòng mAbs linh hoạt khác. Các đường cong không phải parabol cũng được quan sát thấy đối với phức hệ. Chúng khác nhau về vị trí đỉnh ở Q thấp hơn khi so sánh với ASA-IgG2 tự do. Tuy nhiên, tỷ lệ tín hiệu trên nhiễu thấp cản trở việc so sánh trong dải Q cao hơn [2].
Sự thay đổi tỷ lệ (stoichiometry) và cấu trúc của phức hệ ASA-IgG2-tSA trong dung dịch được mô tả bằng cách sử dụng SAXS và mô hình phân tử. Những kết quả này chứng minh rõ ràng khả năng của SAXS trong việc xác định các tương tác protein-protein trong dung dịch, tránh được nhiệm vụ khó khăn của quá trình kết tinh protein-protein hoặc protein-ligand, đôi khi đòi hỏi phải sàng lọc hàng nghìn điều kiện khác nhau, cùng với các hình giả lập được tạo ra bằng cách vẽ lại sự sắp xếp nguyên tử trong tinh thể.
Nguồn: Xenocs
Tìm hiểu thêm về thiết bị tán xạ tia X cho ứng dụng trên tại đây!
Bài viết liên quan:
- Lựa chọn, phân tích đặc tính sinh-lý và cấu trúc kháng thể nano tổng hợp giúp vô hiệu hoá hiệu quả vi rút Sars-coV-2
- Tia X có thể giúp test nhanh COVID-19 tin cậy và nhanh chóng hơn trở thành hiện thực như thế nào
- Sách trắng – Ứng dụng kỹ thuật Tán xạ tia X góc nhỏ (SAXS) để nghiên cứu, phát triển và bào chế thuốc
Nghiên cứu trên được xuất bản trong bài báo sau:
[2] Castellanos, M. M.; Snyder, J. A.; Lee, M.; Chakravarthy, S.; Clark, N. J.; Mcauley, A.; Curtis, J. E. Characterization of monoclonal antibody-protein antigen complexes using small-angle scattering and molecular modeling. Antibodies 2017, 6, 25‒44. http://dx.doi.org/10.3390/antib6040025.[1] Tuukkanen, A. T.; Svergun, D. I. Weak protein–ligand interactions studied by small-angle X-ray Scattering. FEBS J. 2014, 281, 1974–1987. https://doi.org/10.1111/febs.12772
