Sinh học cấu trúc

Sinh học cấu trúc là lĩnh vực nghiên cứu về cấu trúc phân tử và động lực học của các đại phân tử sinh học (đặc biệt là protein được tạo thành từ các axit amin, RNA hoặc DNA được tạo thành từ nucleotide và màng-membranes được tạo thành từ lipid), cách chúng hình thành và những thay đổi trong cấu trúc ảnh hưởng đến chức năng của chúng như thế nào bằng cách kết hợp các phương pháp và nguyên tắc của sinh học phân tử, hóa sinh và lý sinh [1][2].
Bốn kỹ thuật chính trong lĩnh vực sinh học cấu trúc hiện nay
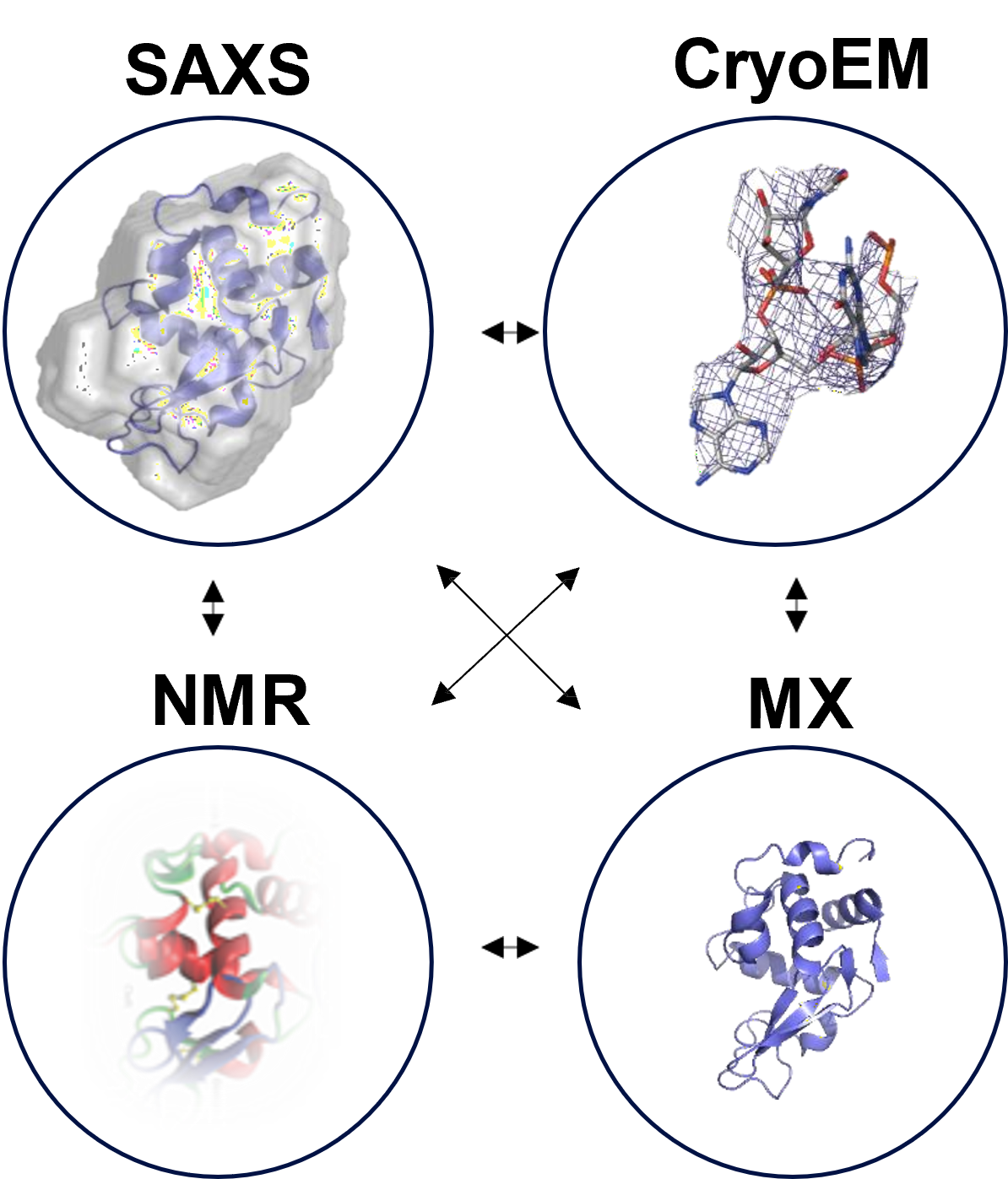
Những tiến bộ công nghệ trong thiết bị đo đạc gần đây đã chứng thực một bước tiến mới trong lĩnh vực sinh học cấu trúc vì các phân tử sinh học phức tạp giờ đây có thể được phân tích một cách dễ dàng và hiệu quả chưa từng có. Cấu trúc ba chiều (3D) của protein và phức hợp protein (protein complexes) có thể cung cấp những hiểu biết sâu sắc về quy luật hoạt động sống và cơ chế gây ra bệnh tật, và do đó cho phép thiết kế các loại chẩn đoán và điều trị mới [4].
Có nhiều phương pháp luận với các nguyên tắc vật lý rất khác nhau dùng để nghiên cứu trong lĩnh vực này, chẳng hạn như tinh thể học tia X (X-ray Crystallography), cộng hưởng từ hạt nhân (NMR), kính hiển vi điện tử lạnh (Cryo-EM), tán xạ góc nhỏ (Small angle scattering – SAS, bao gồm SAXS & SANS) và các kỹ thuật quang phổ khác [5]. Trong số này, X-ray Crystallography, NMR, Cryo-EM và SAS đại diện cho bốn kỹ thuật chính được sử dụng rộng rãi để tiết lộ thông tin cấu trúc liên quan đến nhiều loại đại phân tử. Tuy nhiên, không có kỹ thuật nào nào có thể đạt được tất cả mục đích vì cả bốn kỹ thuật này đều có những ưu điểm cũng như hạn chế riêng [4].

Do vậy, bài viết này nhằm mục đích giới thiệu chi tiết hơn các kỹ thuật trên cũng như các ưu điểm, nhược điểm khi vận dụng trong lĩnh vực này. Việc hiểu bản chất các công cụ này cũng sẽ giúp việc lựa chọn sử dụng sao cho phù hợp trong nghiên cứu đạt hiệu quả cao hơn, cũng như tránh được lãng phí thời gian, công sức và tiền bạc tương ứng.
Ngoài ra, bài viết cũng xin được nhấn mạnh hơn vào một kỹ thuật có thể phân tích cấu trúc sinh học trong dung dịch đang nhận được rất nhiều sự quan tâm trong những năm gần đây là tán xạ góc nhỏ (SAS) nói chung và tán xạ tia X góc nhỏ (SAXS) nói riêng. Bởi kỹ thuật này có thiết lập đơn giản nhưng dữ liệu thu thập được có thể cung cấp một lượng thông tin cấu trúc có giá trị đáng ngạc nhiên về các phân tử sinh học ở trạng thái gần tự nhiên nhất giống với tế bào sống hay trong điều kiện sản xuất một cách nhanh chóng, dẫn đến việc thúc đẩy các giai đoạn nghiên cứu, khám phá, tạo ra các loại thuốc và vaccine thế hệ mới hiệu quả và nhanh chóng hơn bao giờ hết.
1. Tinh thể học tia X (X-ray Crystallography)
Lý thuyết cơ bản
Với khả năng phân giải cấu trúc của các đại phân tử ở độ phân giải nguyên tử, tinh thể học tia X là công cụ mạnh mẽ nhất trong sinh học cấu trúc hiện đại. Kỹ thuật này sử dụng tia X để xác định vị trí và sự sắp xếp của các nguyên tử trong tinh thể. Phương pháp cổ điển nhất và chính xác nhất của tinh thể học tia X là nhiễu xạ tia X đơn tinh thể (Single Crystall X-ray Diffraction), ở đây các nguyên tử của tinh thể tương tác chùm tia X tới tạo ra chùm tia tán xạ. Khi chùm tia phân tán trên detector, những chùm tia này sẽ tạo ra hình ảnh các điểm nhiễu xạ lốm đốm. Khi tinh thể quay dần, góc và cường độ của các chùm nhiễu xạ này có thể được đo, và sau đó hình ảnh ba chiều của mật độ điện tử trong tinh thể được tạo ra. Dựa trên mật độ electron này, có thể xác định vị trí trung bình của các nguyên tử trong tinh thể, các liên kết hóa học, hàng rào tinh thể (crystall barriers) và nhiều thông tin khác nhau. Đối với một đơn tinh thể có đủ độ tinh khiết, đồng nhất và đều đặn, dữ liệu nhiễu xạ tia X có thể xác định góc và lực liên kết hóa học trung bình giữa các nguyên tử và góc giữa chúng trong khoảng vài chục độ và vài ngàn Ångström, tương ứng [4].
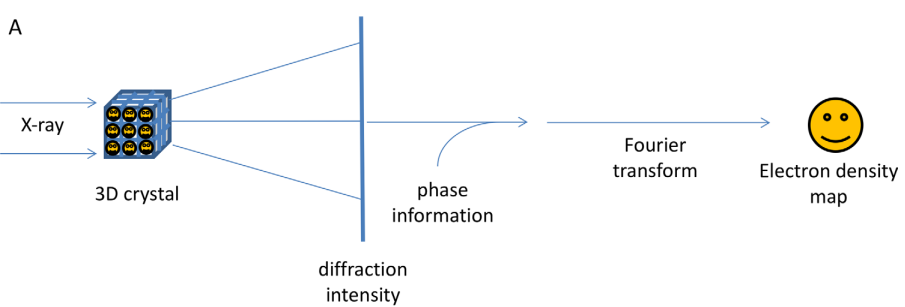
Lịch sử và thực tế
Quy trình
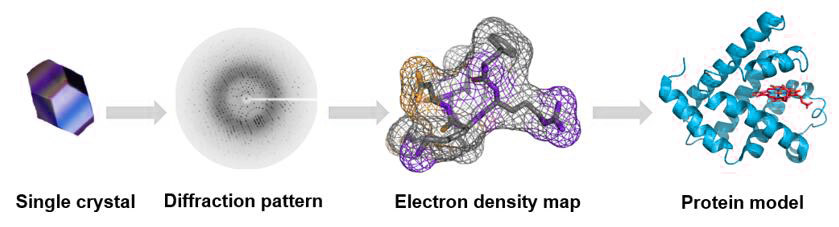
Ưu điểm
Nhược điểm
2. Kính hiển vi điện tử lạnh (Cryo-EM)
Lý thuyết cơ bản
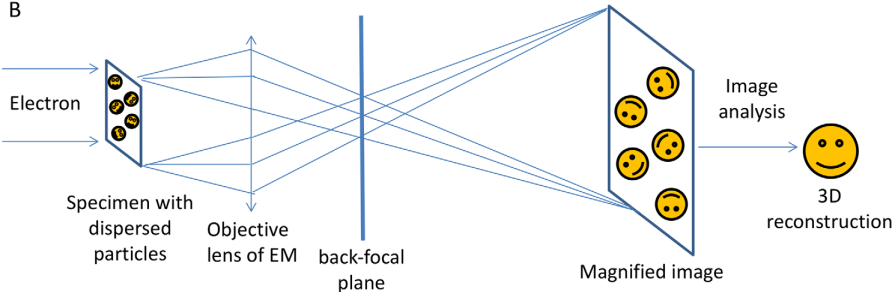
Lịch sử và thực tế
Quy trình
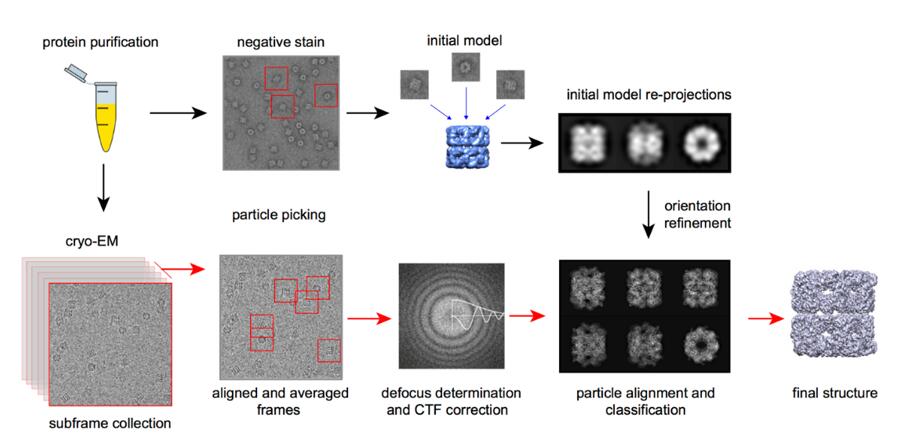
Ưu điểm
Nhược điểm
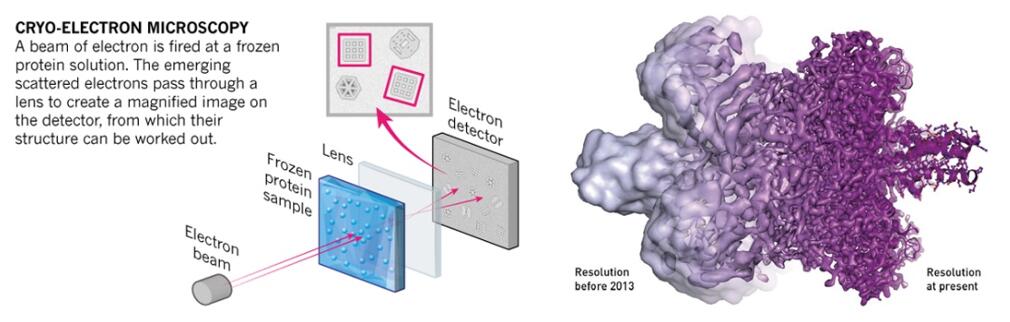
3. Cộng hưởng từ hạt nhân (NMR)
Lý thuyết cơ bản
Phương pháp thứ ba là cộng hưởng từ hạt nhân (NMR). Hạt nhân là các hạt mang điện, quay nhanh (fast spinning particles), tương tự như các electron ở lớp vỏ. Tỷ lệ quay (gyromagnetic ratios) của các hạt nhân nguyên tử khác nhau là khác nhau và do đó có tần số cộng hưởng khác nhau. Chuyển động của hạt nhân không đứng im – nó tương tác với các nguyên tử xung quanh cả trong lẫn giữa các phân tử với nhau. Do đó, thông qua phổ cộng hưởng từ hạt nhân, thông tin cấu trúc của một phân tử nhất định có thể thu được. Lấy protein làm ví dụ, cấu trúc thứ cấp (secondary structure) của nó, chẳng hạn như xoắn α (α-helix), tấm β (β-sheet), xoay (turn), tròn (circular) và cuộn tròn (curl), phản ánh sự sắp xếp khác nhau của các nguyên tử trong chuỗi chính của phân tử protein theo ba chiều. Khoảng cách của các hạt nhân nguyên tử trong các miền thứ cấp khác nhau, sự tương tác giữa các hạt nhân và đặc tính động của các đoạn polypeptitde đều phản ánh trực tiếp cấu trúc ba chiều của protein. Các đặc điểm này đều góp phần vào phổ của mẫu được phân tích, do đó cung cấp các tín hiệu NMR đặc trưng. Việc diễn giải các tín hiệu này bằng các phương pháp có sự hỗ trợ của máy tính dẫn đến việc giải mã cấu trúc ba chiều [4].
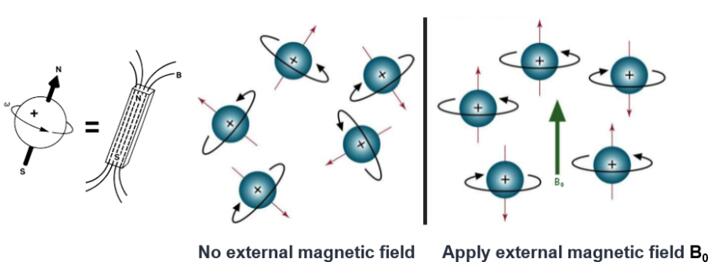
Lịch sử và thực tế
Quy trình
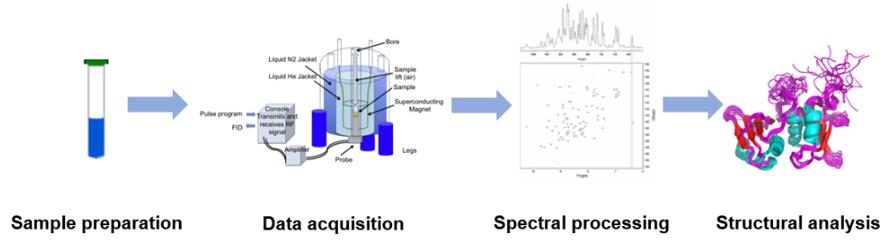
Ưu điểm
Nhược điểm
4. Tán xạ góc nhỏ (SAS)
Lý thuyết cơ bản
Cuối cùng là phương pháp tán xạ góc nhỏ (SAS). Tán xạ góc nhỏ (SAS) bao gồm tán xạ tia X góc nhỏ (SAXS) và tán xạ Neutron góc nhỏ (SANS) là các kỹ thuật được sử dụng để mô tả đặc tính cấu trúc của nhiều loại vật liệu trên thang độ dài từ nm đến μm và định lượng phản ứng của nó đối với những thay đổi điều kiện bên ngoài. Nguyên lý chính của tán xạ góc nhỏ của tia X (SAXS) và Neutron (SANS) dựa vào sự khác biệt mật độ điện tử (đối với tia X) hoặc mật độ hạt nhân/spin (đối với Neutron) của cấu trúc nano từ các vật liệu khối (bulk materials) hoặc vật liệu lắng đọng trên bề mặt (materials deposited at surfaces). Việc phân tích dữ liệu SAS từ tán xạ kết hợp (coherent scattering) cung cấp nhiều thông tin của vật liệu như cấu trúc và hình thái. Do vậy, tán xạ góc nhỏ (SAS) có thể được áp dụng để thăm dò cấu trúc của hầu hết các loại vật liệu khác nhau từ hợp kim kim loại và polyme đến vật liệu xốp, hạt nano, nanocompozit, nhũ tương và các đại phân tử sinh học trong dung dịch. Hơn nữa, các mẫu cho các nghiên cứu SAS có thể được chuẩn bị tại chỗ (in-situ) hoặc trong các điều kiện gần môi trường tự nhiên (near-native conditions) và các phép đo được thực hiện ở các nhiệt độ, áp suất, dòng chảy (flows), làm biến dạng (shears) hoặc ứng suất (stresses) khác nhau theo phân giải thời gian (time-resolved) [16-17].
Trong lĩnh vực sinh học, tán xạ góc nhỏ (SAS) hiện là một trong những công cụ chính dùng để nghiên cứu cấu các đại phân tử trong dung dịch. SAS cho phép nghiên cứu cấu trúc của các hạt sinh học nguyên dạng trong môi trường gần sinh lý và phân tích sự thay đổi cấu trúc để đáp ứng với các biến đổi của điều kiện bên ngoài [16]. Kỹ thuật này có nhiều ưu điểm như không yêu cầu phải chuẩn bị mẫu phức tạp như kết tinh mẫu hay đông lạnh và có thể áp dụng cho một loạt các kích thước khác nhau từ peptide cho đến các đại phân tử phức tạp có trọng lượng từ vài kDa đến GDa. Điều này mang lại những hiểu biết độc đáo về thông tin cấu trúc về các miền bị rối loạn (disordered) và linh hoạt (flexible) của protein và vật liệu di truyền [18].
Về mặt ý tưởng, các thí nghiệm SAS rất đơn giản: chiếu một chùm tia X hoặc một chùm tia Neutron chuẩn trực hoặc hội tụ cao lên một dung dịch chứa vật liệu sinh học, sau đó thu tia tán xạ từ mẫu tại góc nhỏ (0.1° – 10°) bằng máy dò (detector) 2D và tái tạo hình dạng 3D cùng các thông tin liên quan từ dữ liệu thu được.
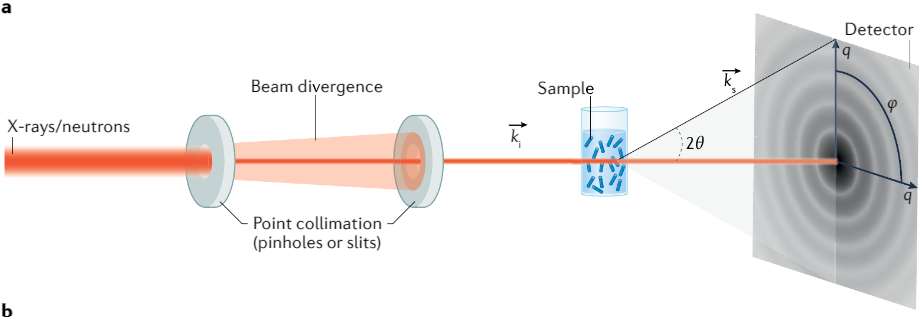
Hình 10: Một thiết lập tán xạ góc nhỏ (SAS) cơ bản trong đó chùm tia X hoặc Neutron tới truyền qua một mẫu được đặt trong đường đi của chùm tia (thường vuông góc với hướng chùm tia tới). Cường độ mà chùm tia tới truyền qua mẫu được xác định bởi nhiều yếu tố bao gồm năng lượng tia X hoặc Neutron, tính chất hấp thụ và tán xạ và độ dày của mẫu. [17]
-Tuy vậy, tán xạ Neutron góc nhỏ (SANS) yêu cầu nguồn Neutron từ lò phản ứng hạt nhân hoặc cơ sở phân hạch, cộng thêm gánh nặng / lợi ích của việc đánh dấu đồng vị để tối đa hóa độ tương phản tán xạ Neutron [19]. Do đó SANS vẫn còn nhiều hạn chế và phải phụ thuộc vào các cơ sở lớn, chưa phát triển được thiết bị chuyên dụng trong phòng thí nghiệm nên SANS khó phổ biến hơn SAXS. Do vậy, bài viết này sẽ tập trung hơn vào SAXS, một công cụ dễ tiếp cận hơn cho cộng đồng khoa học Việt Nam.
-Trong nhiều năm trước đây, các nghiên cứu tán xạ tia X góc nhỏ (SAXS) trong sinh học thường được thực hiện giới hạn tại các trung tâm gia tốc Synchrotron có nguồn bức xạ tia X cường độ cực cao, bởi vì các phân tử sinh học thường tán xạ yếu và dung dịch đo loãng. Nhưng hiện nay thiết bị SAXS cho phòng thí nghiệm đã vượt qua các giới hạn để trở nên phổ biến hơn do những tiến bộ vượt bậc về mặt thiết bị trong thập kỷ qua. Thiết bị SAXS dành riêng cho nhu cầu của lĩnh vực sinh học cấu trúc để phát triển thuốc trong phòng thí nghiệm đã dễ tiếp cận hơn và có sẵn trên thị trường. Chúng bao gồm các giải pháp tự động hóa và thông lượng cao với lượng mẫu đo thấp. Điều này giúp SAXS trở thành một phần hữu ích trong hộp công cụ phân tích cấu trúc sinh học, dùng để mô tả đặc điểm hình dạng và kích thước của protein (bao gồm cả kháng thể và kháng nguyên), hay phức hợp protein, cũng như để nghiên cứu DNA và RNA hàng này trong phòng thí nghiệm. Hơn nữa, các ứng dụng liên quan của SAXS trong các lĩnh vực dược phẩm, như bào chế và phân phối thuốc, gần đây đã trở nên rõ ràng hơn và góp phần rút ngắn thời gian đưa ra thị trường của các loại thuốc và vắc xin thế hệ mới. [21]
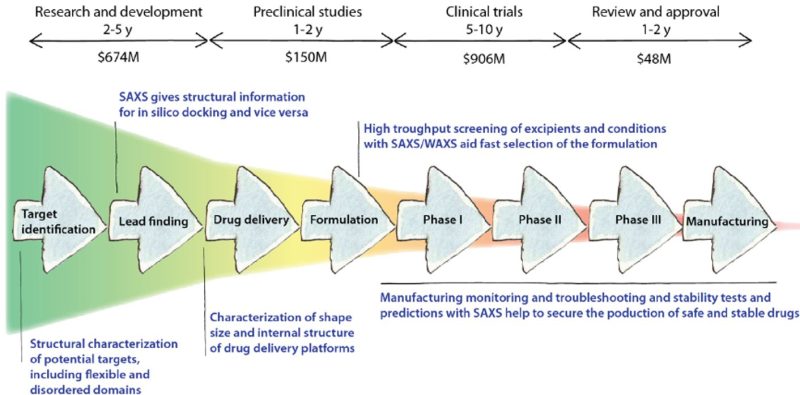
Lịch sử và thực tế
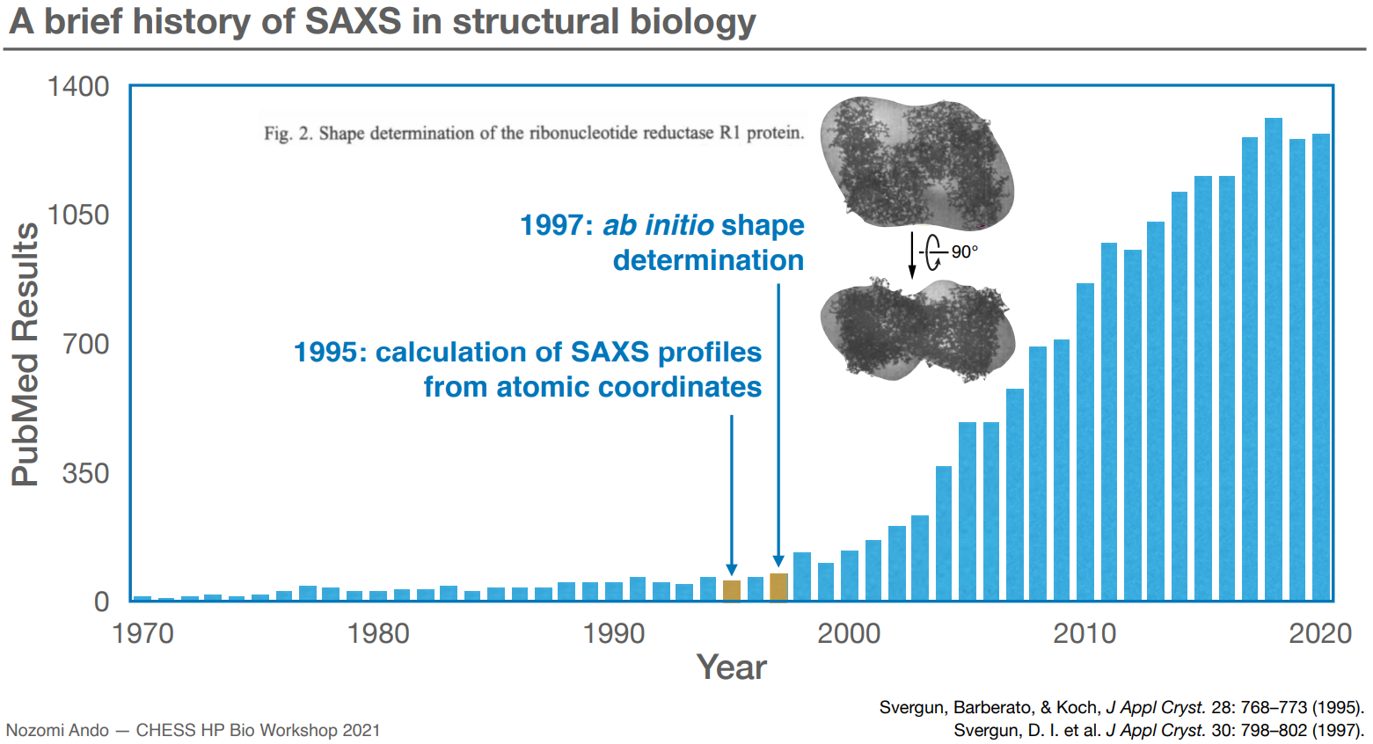
Quy trình
Hình dưới là hình ảnh tổng quát của quá trình thí nghiệm và phân tích SAXS trong sinh học. Thiết lập thí nghiệm bao gồm bước sóng tia X (thường khoảng 0,15 nm) và khoảng cách từ mẫu đến máy dò được quyết định trước dựa trên kích thước mà bạn quan tâm (ví dụ: kích thước tổng thể của mẫu hoặc kích thước quan tâm trong hoặc giữa mẫu). Mẫu vật liệu sinh học cho thí nghiệm SAXS rất đa dạng và lý tưởng nhất là các hệ đơn phân tán (monodisperse) trong dung dịch hay mẫu có độ tinh khiết cao [22]. Nhưng trong thực tế, SAXS cũng có thể áp dụng cho các trường hợp không lý tưởng khi các hệ đa phân tán (polydisperse) do khác nhau về kích thước hoặc hình dạng và tương tác giữa các hạt không thể bị bỏ qua [16]. Sau khi chuẩn bị mẫu tối thiểu, mẫu sẽ được đưa vào ô mẫu và được chiếu bằng chùm tia X. Tia X sau khi truyền qua mẫu sẽ phân tán ở góc nhỏ (<10°) được máy dò 2D ghi lại và một loạt các hình ảnh 2D sẽ được sử dụng để lấy trung bình. Tùy thuộc vào loại thí nghiệm, những bước tương tự được tiến hành trên mẫu trắng (ví dụ: nước hoặc dung dịch đệm không có phân tử đích) để trừ nền. Sau khi thu được đường cong tán xạ từ các hình ảnh, bạn có thể đưa nó đến phân tích tính toán sâu hơn (ví dụ: mô hình cấu trúc 3D). SAXS khá mạnh mẽ, đặc biệt là bằng cách kết hợp với thông tin bổ sung từ các thí nghiệm sinh hóa và lý sinh khác như SC-XRD, Cryo-EM và NMR [22].
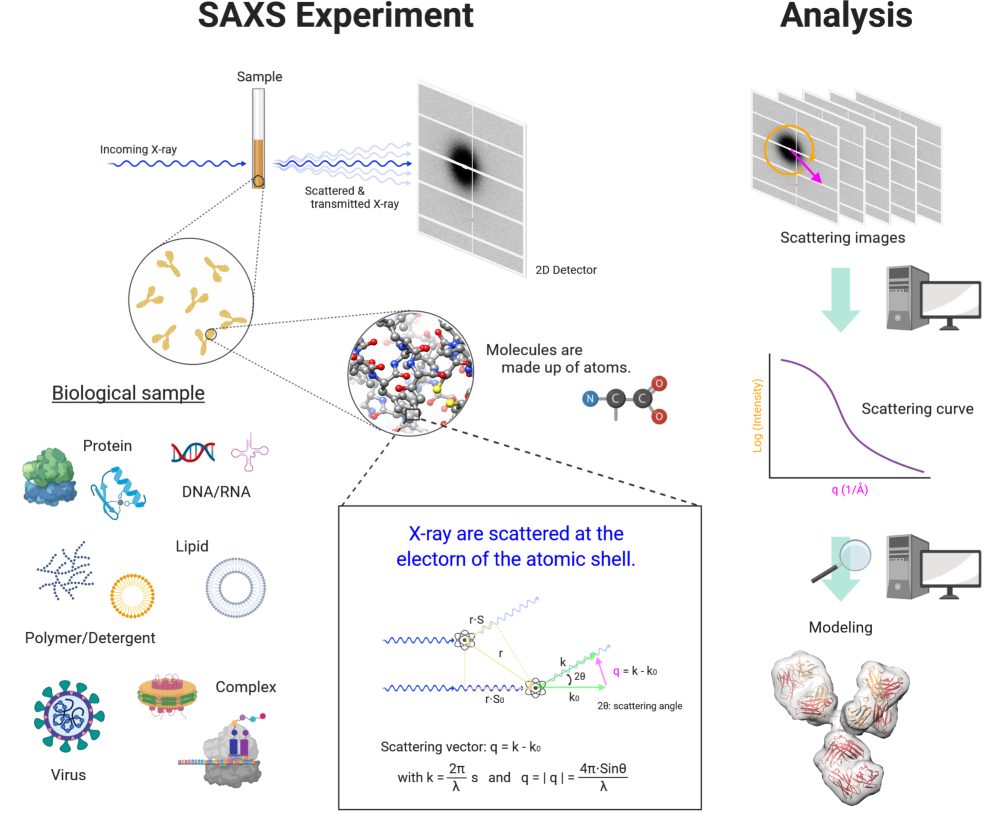
Hình 13: Quy trình kỹ thuật tán xạ tia X góc nhỏ (SAXS) điển hình [22].
Ưu điểm
Lợi thế của SAS nói chung nằm ở chỗ mẫu không cần phải kết tinh như kỹ thuật tinh thể học (X-ray Crystallography) hoặc mẫu đông lạnh với kỹ thuật kính hiển vi điện tử lạnh (Cryo-EM), hay không bị giới hạn trọng lượng phân tử < 40-50 kDa với kỹ thuật cộng hưởng từ hạt nhân (NMR) mà chỉ yêu cầu chuẩn bị mẫu ở mức tối thiểu, mẫu có thể được đo ngay trong dung dịch ở trạng thái gần tự nhiên nhất. Môi trường dung dịch cũng cho phép áp dụng kỹ thuật ở các điều kiện gần giống với môi trường sinh lý của mẫu (nhiệt độ, pH, nồng độ muối hoặc áp suất cao,…). Kỹ thuật này cũng có thể được áp dụng để quan sát trực tiếp các phản ứng sinh hóa khi chúng đang xảy ra và đo động học của chúng bằng cách sử dụng các phép đo phân giải theo thời gian của tín hiệu tán xạ góc nhỏ [12][16].
Nhược điểm
Mặc dù, việc chuẩn bị mẫu cho thí nghiệm SAXS chỉ ở mức tối thiểu, không cần kết tinh hay đông lạnh mẫu nhưng đòi hỏi mẫu có đủ độ tương phản và cần chú ý mẫu có thể hư hại do sử dụng nguồn tia X cực cao ở trung tâm Synchrotron (nguồn tia X phòng thí nghiệm thấp hơn nhiều nên không gặp vấn đề này). Kết quả thu được được biểu diễn trong không gian đảo (replocical space) với độ phân giải thấp (<10 A° – 20 A°) nên việc xây dựng model từ dữ liệu phân tích có thể cần bổ sung thêm thông tin từ các kỹ thuật khác để giải quyết sự mơ hồ trong giải thích kết quả [12][16]. Cuối cùng là vấn đề beamtime, do số lượng các cơ sở lớn như Synchrotron và cơ sở hạt nhân giới hạn nên các nhà nghiên cứu phải nộp đơn trước hàng tháng trước khi được sử dụng, trong quá trình chờ gửi đến đo, mẫu có thể bị biến đổi hoặc bị hỏng (vấn đề này có thể giải quyết được với thiết bị SAXS trong phòng thí nghiệm giúp nhà nghiên cứu phân tích mẫu hàng ngày 24/7/365, để tăng hiệu suất công việc) [19][26]. Nhưng hiện nay, Việt Nam hiện vẫn chưa có một thiết bị SAXS chuyên dụng cho lĩnh vực sinh học cấu trúc, không phải do vấn đề chi phí đầu tư quá lớn (một thiết bị SAXS thương mại có giá tương đương hoặc thấp hơn những máy SC-XRD hay NMR đang được sử dụng ở Việt Nam) mà phần nhiều là do lĩnh vực nghiên cứu sinh học cấu trúc cơ bản chưa có nhiều sự tham gia của các nhà khoa học Việt Nam và sự đầu tư cho lĩnh vực này còn nhiều hạn chế. Hy vọng trong thời gian tới cộng đồng khoa học Việt Nam sẽ quan tâm, đầu tư thời gian, công sức và thiết bị nhiều hơn cho lĩnh vực sinh học cấu trúc, một lĩnh vực cực kỳ quan trọng và được coi là nền tảng của ngành sinh học ngày nay.
Tổng kết
Tóm lại, mỗi kỹ thuật đều có ưu điểm, nhược điểm riêng khi vận dụng trong lĩnh vực này. Trong một số ứng dụng nhất định thì có kỹ thuật này được sử dụng rộng rãi nhưng lại hiếm khi sử dụng bằng kỹ thuật kia. Như vậy, hiểu bản chất của phân tích là chìa khóa trong việc lựa chọn kỹ thuật phù hợp với đối tượng nghiên cứu để đạt hiệu quả hay hiệu suất cao hơn, cũng như tránh được lãng phí thời gian, công sức và tiền bạc tương ứng.
Xem bảng tổng kết dưới đây:
| Phương pháp | Mẫu protein | Ưu điểm | Nhược điểm |
MX (Macromolecular Crystallography) hay SC-XRD | tinh thể (cần khoảng 10 mg protein tinh khiết) | -Đã có nền tảng phát triển tốt trong nhiều năm, vẫn là tiêu chuẩn vàng cung cấp thông tin chi tiết có độ phân giải cỡ nguyên tử -Độ phân giải cao (<1 A°) -Không bị giới hạn bởi trọng lượng phân tử của mẫu -Xác định cấu trúc nhanh, dễ dàng xây dựng model | -Yêu cầu mẫu phải kết tinh -Cần lượng lớn tinh thể có cấu trúc tốt – đơn tinh thể, nếu không sẽ khó có nhiễu xạ tốt. Trong khi đó, nuôi tinh thể là một thách thức (cần độ tinh khiết cao, tránh tạp gây ra hiện tượng crystallization artifacts và nhiều protein khó kết tinh như membrane proteins, do kích thước lớn và khả năng hòa tan tương đối kém). -Môi trường không tự nhiên, phi sinh lý -Kết quả thu được ở trạng thái tĩnh, không thấy được các phần linh hoạt hay trạng thái động của protein -Đóng gói tinh thể ảnh hưởng đến cấu trúc protein. -Beamtime với trung tâm Synchrotron. Do số lượng có hạn nên các nhà nghiên cứu phải nộp đơn trước hàng tháng trước khi được sử dụng. (vấn đề này có thể giải quyết được với thiết bị SC-XRD trong phòng Lab, nhưng thời gian thu thập sẽ lâu hơn rất nhiều do nguồn sáng thấp hơn rất nhiều so với Synchrotron.) |
| NMR | dung dịch loãng (khoảng 5-10 mg/mL) | -Không yêu cầu mẫu phải kết tinh thành tinh thể -Không phá hủy mẫu và không xâm lấn -Cấu trúc 3D của protein ở trạng thái gần tự nhiên trong dung dịch -Hữu hiệu cho nghiên cứu động học protein (protein folding, sự thay đổi khi liên kết với ligand,…) -Độ phân giải cao (khoảng 2-3 A°) | -Giới hạn protein nhỏ dưới 40 -50 kDa có độ ổn định cao, tinh khiết cao, nồng độ cao, hoàn tan và không kết tụ ở nồng độ cao cần thiết để thu thập dữ liệu -Chuẩn bị mẫu khó -Yêu cầu lượng lớn mẫu có độ tinh khiết cao để đạt được tín hiệu trên nhiễu (signal-to-noise) ở mức chấp nhận được -Rất nhạy với chuyển động, có thể dẫn đến biến dạng tín hiệu và tín hiệu giả -Khó xử lý dữ liệu và mô phỏng tính toán -Thời gian trung bình: tháng -Tạo ra một tâp hợp các cấu trúc khả thi chứ không phải là một model -Bio-NMR cho protein phải có từ trường / tần số cao, tối thiểu là 600MHz trở lên. -Từ trường cao có thể gây sự cố với các thiết bị khác trong PTN. Do đó, có thể cần phải thực hiện các biện pháp phòng ngừa bổ sung, đặc biệt nếu không gian làm việc bị hạn chế. |
| Cryo-EM | đông lạnh nhanh mẫu trong dung dịch loãng (<1 mg/mL) | -Không yêu cầu mẫu phải kết tinh thành tinh thể -Lượng mẫu yêu cầu nhỏ, ít hạn chế về độ tinh khiết của mẫu -Mẫu được xử lý đông lạnh nhanh để duy trì trạng thái gần tự nhiên -Đánh giá trực tiếp được hình dạng và tính đối xứng của hạt protein -Độ phân giải tương đối cao (<10 A°, cao nhất đạt được là 1.2 A°) | -Tỷ lệ tín hiệu trên nhiễu rất thấp (signal-to-noise) hay độ tương phản thấp của hình ảnh được chụp, đòi hỏi detector và xử lý hình ảnh tiên tiến cao. -Không áp dụng cho phân tử có trọng lượng ít hơn 200 kDa (chỉ cho loại protein lớn hay protein phức hợp (complexes) -Chuẩn bị mẫu rất phức tạp (không chỉ đòi hỏi phải tối ưu hóa độ dày lớp băng mà còn phải tối ưu hóa sự phân bố hạt trên lưới đỡ. Đôi khi các protein có định hướng ưu tiên khiến việc tái tao hình dạng 3D không thể thực hiện được. -Phụ thuộc vào việc sử dụng loại kỹ thuật Electron Microscopy nào -Rào cản phần cứng và phần mềm. Hiện nay, thiết bị Cryo-EM tiên tiến vẫn cực kỳ đắt tiền, kèm thêm các chi phí phòng vận hành, hợp đồng dịch vụ và đội ngũ nhân viên giàu kinh nghiệm nên vẫn rất khó tiếp cận. |
| SAXS | dung dịch loãng hoặc bán-loãng (1-100 mg/mL) | -Không yêu cầu mẫu phải kết tinh thành tinh thể -Chuẩn bị mẫu đơn giản, ở mức tối thiểu -Mẫu ở trong dung dịch, trạng thái gần tự nhiên nhất -Phân tích được tương tác protein-protein trong điều kiện gần giống trong tế bào -Trạng thái kết tụ (aggregation) trong dung dịch -Phân tích cấu trúc trong hỗn hợp, phức hợp và ở điều kiện không cân bằng (pH, nhiệt độ, áp suất,…) -Phạm vi trọng lượng phân tử rộng (khoảng vài kDa cho tới hàng GDa) -Phân giải thời gian (khoảng ms ở Synchrotron, khoảng phút – giờ với thiết bị SAXS phòng thí nghiệm) | -Kết quả ở không gian đảo (replocical space) -Độ phân giải thấp (<10 A° – 20 A°) -Yêu cầu mẫu đủ độ tương phản -Mẫu có thể bị hư hại khi đo ở Synchrotron do nguồn bức xạ quá lớn (nhưng với nguồn bức xạ ở phòng thí nghiệm thì không sao) -Xây dựng model từ dữ liệu phân tích nhưng cần bổ sung thêm thông tin từ các kỹ thuật khác để giải quyết sự mơ hồ. -Beamtime với trung tâm Synchrotron. Do số lượng có hạn nên các nhà nghiên cứu phải nộp đơn trước hàng tháng trước khi được sử dụng (vấn đề này có thể giải quyết được với thiết bị SAXS phòng thí nghiệm giúp nhà nghiên cứu phân tích mẫu hàng ngày 24/7/365, để tăng hiệu suất công việc). -Việt Nam hiện vẫn chưa có một thiết bị SAXS chuyên dụng cho lĩnh vực sinh học cấu trúc, không phải do vấn đề chi phí đầu tư quá lớn (một thiết bị SAXS thương mại có giá tương đương hoặc thấp hơn những máy SC-XRD hay NMR đang được sử dụng ở Việt Nam) mà phần nhiều là do lĩnh vực nghiên cứu sinh học cấu trúc cơ bản chưa có nhiều sự tham gia của các nhà khoa học Việt Nam và sự đầu tư cho lĩnh vực này còn nhiều hạn chế. |
| SANS | dung dịch loãng hoặc bán-loãng (1-100 mg/mL) | -Tương tự như SAXS nhưng phân giải thời gian thấp hơn -Không phá hủy mẫu -Nhiều biến thể tương phản, dễ dàng áp dụng bằng cách thay đổi tỉ lệ H2O/D2O để nghiên cứu phức hợp nucleic axit – protein hoặc lipid-protein hoặc phức hợp protein-protein | -Tương tự như SAXS -Chưa có SANS phòng Lab và vẫn phải phụ thuộc vào nguồn Neutron từ lò phản ứng hoặc cơ sở phân hạch, cộng thêm gánh nặng / lợi ích của việc đánh dấu đồng vị để tối đa hóa độ tương phản tán xạ Neutron.
|
| DLS/SLS* | dung dịch cực loãng (<1 mg/mL) | -Không phá hủy mẫu -Lượng mẫu yêu cầu nhỏ -Thí nghiệm đơn giản, nhanh chóng -Chi phí đầu tư thấp hơn | -Chỉ xác định được các thông số trung bình -Phù hợp với các hệ đơn phân tán (monodisperse) -Kết quả kém chính xác khi hạt không có dạng hình cầu, vì DLS/SLS chỉ có duy nhất một giả định các hạt đều là hình cầu. -Độ phân giải thấp do hạn chế của các bước sóng quang học sẽ không cung cấp mức độ phân giải cấu trúc cho bất kỳ thứ gì nhỏ hơn 0,5 µm. |
*Bổ sung thêm phần so sánh với kỹ thuật tán xạ ánh sáng (DLS/SLS) vốn đang được sử dụng tương đối nhiều ở Việt Nam để cung cấp thông tin kích thước tiểu phân nano trong lĩnh lực khoa học vật liệu, sinh học, dược phẩm,…
Nguyễn Tiến Dũng tổng hợp
Nguồn tham khảo:
- 1)https://www.nature.com/subjects/structural-biology
- 2)Banaszak LJ (2000). Foundations of Structural Biology. Burlington: Elsevier. ISBN 9780080521848.
- 3)https://www.lanl.gov/discover/news-release-archive/2020/January/0109-heart-rna-structure.php
- 4)https://www.creative-biostructure.com/comparison-of-crystallography-nmr-and-em_6.htm
- 5)https://www.kbdna.com/publishinglab/struc-bio
- 6)How cryo-electron microscopy and X-ray crystallography complement each other. https://onlinelibrary.wiley.com/doi/pdf/10.1002/pro.3022
- 7)Cryo electron microscopy to determine the structure of macromolecular complexes. https://www.sciencedirect.com/science/article/pii/S1046202315301638
- 8)The revolution will not be crystallized: a new method sweeps through structural biology. https://www.nature.com/articles/525172a
- 9)https://www.nobelprize.org/uploads/2018/06/advanced-chemistryprize2017.pdf
- 10)https://www.science.org/content/article/democratizing-cryo-em-broadening-access-expanding-field
- 11)https://thebiologist.rsb.org.uk/biologist-features/focus-on-cryo-electron-microscopy
- 12)Small-Angle X-Ray Scattering Applied to Proteins in Solution. Doi: https://doi.org/10.1002/9781118523063.ch3
- 13)https://nmrhanoi.blogspot.com/2018/07/mo-may-nmr-2000-mhz.html
- 14)https://cen.acs.org/business/instrumentation/Bruker-installs-12-GHz-NMR/98/i19
- 15)https://nmrhanoi.blogspot.com/p/1.html
- 16)Small-angle scattering studies of biological macromolecules in solution. Dmitri I Svergun and Michel H J Koch. DOI: https://doi.org/10.1088/0034-4885/66/10/R05
- 17)Small-angle X-ray and neutron scattering. Jeffries, C.M., Ilavsky, J., Martel, A. et al. Nat Rev Methods Primers 1, 70 (2021). https://doi.org/10.1038/s43586-021-00064-9
- 18)A practical guide to small angle X-ray scattering (SAXS) of flexible and intrinsically disordered proteins. https://doi.org/10.1016/j.febslet.2015.08.027
- 19)https://www.xenocs.com/knowledge-base/saxs/
- 20)https://en.wikipedia.org/wiki/Biological_small-angle_scattering
- 21)https://www.xenocs.com/saxs-for-drug-development-and-formulations-a-white-paper/
- 22)https://www-ssrl.slac.stanford.edu/smb-saxs/content/what-biosaxs
- 23)Small Angle Scattering: Historical Perspective and Future Outlook. DOI 10.1007/978-981-10-6038-0_1
- 24)How structural biology helps to make RNA vaccines. https://www.embl.org/news/science/how-structural-biology-helps-to-make-rna-vaccines/
- 25)https://www.chess.cornell.edu/sites/default/files/inline-files/HPBioSAXS_Ando.pdf
- 26)https://www.xenocs.com/saxs-products/biosaxs-instrument-bioxolver/
- 27)https://www.youtube.com/watch?v=uWonjUMrKI8&ab_channel=BioCAT
