Albumin huyết thanh bò (BSA)

SAXS được sử dụng để thăm dò sự dimer hóa của protein BSA trong dung dịch
Quy trình đo
Các thí nghiệm SAXS được thực hiện trên BSA ở nồng độ 0,6 đến 40 mg/ml trong 50 mM Bis-Tris pH 6,0 ở 25 ° C bằng thiết bị SAXS trong phòng thí nghiệm của Xenocs (Xeuss 3.0 được trang bị nguồn tia X – GeniX 3D). Các mẫu được nạp vào một đĩa 96 giếng kín. Thể tích mỗi mẫu là 15 μl. Năm và hai mươi khung hình trong 120 giây được thu thập cho BSA ở nồng độ lần lượt là ≥ 2,5 mg/ml và ≤1,25 mg/ml. Việc suy biến dữ liệu được thực hiện tự động bằng phần mềm Xenocs. Các đường cong tán xạ được fit và phân tích bằng cách sử dụng các chương trình phần mềm CRYSOL và OLIGOMER. [3]
Kết quả
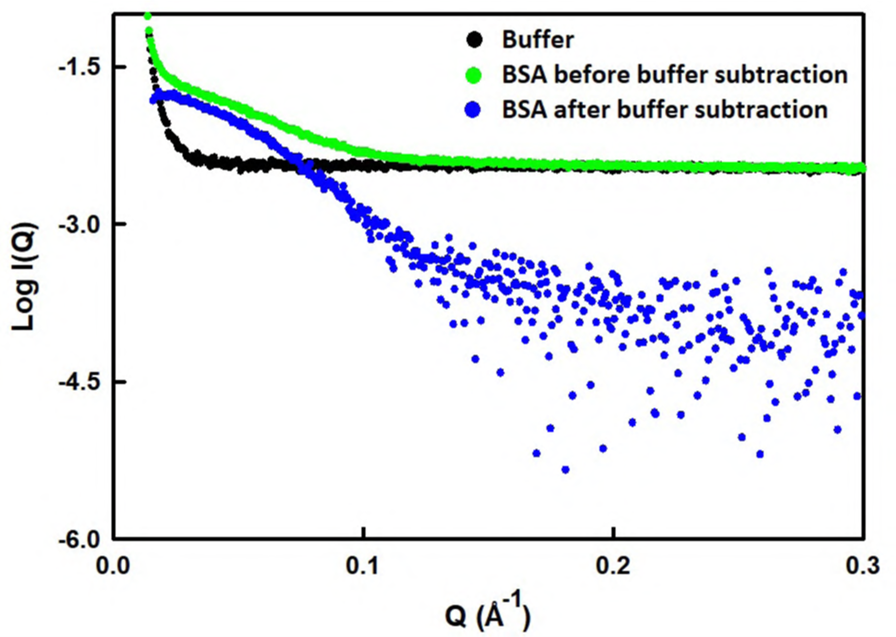
Các profile cường độ SAXS điển hình của BSA (2,5 mg/ml) trước và sau khi trừ nền của dung dịch đệm được thể hiện trong Hình 1. Sự phụ thuộc các profile cường độ SAXS theo nồng độ của BSA được thể hiện trong Hình 2A.
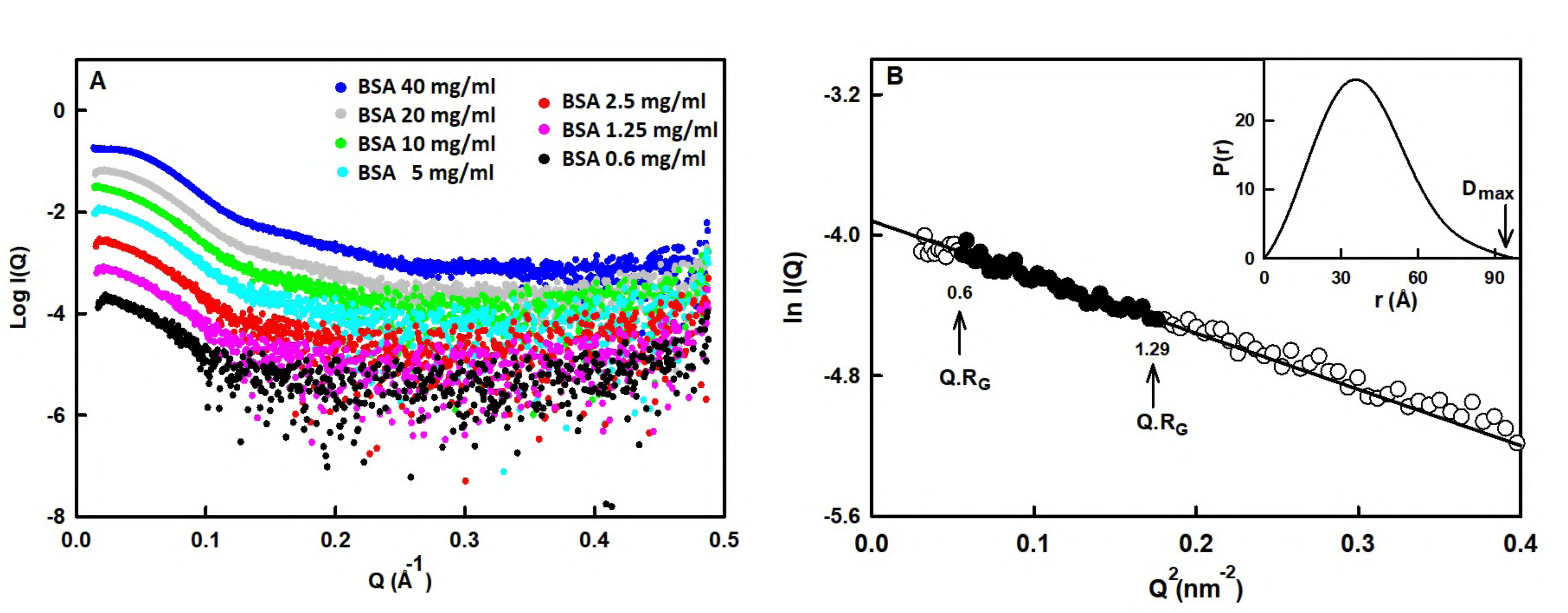
Bán kính hồi chuyển thực nghiệm (RG) được tính từ hệ số góc (slope) của biểu đồ Guinier (ln I(Q) so với Q2) ở các góc nhỏ nhất như trong Hình 2B. Kết quả phân tích dữ liệu SAXS ở nồng độ protein thấp chứng minh rằng: i) giá trị RG thực nghiệm thấp hơn RG được mô hình hóa cho dimer và cao hơn RG được mô hình hóa cho monomer; ii) kích thước lớn nhất Dmax trong thực nghiệm nhỏ hơn Dmax được mô hình hóa cho dimer và lớn hơn Dmax được mô hình hóa cho cấu trúc monome (hình 2B). Những điều này chỉ ra rằng cả monomer và dimer của BSA đều có mặt trong dung dịch.
Fit đường cong SAXS của cấu trúc monome BSA [lấy từ protein data bank(PDB): 4f5s] được phân tích cho thấy giá trị RG là 28,7 Å, giá trị Dmax là 88 Å và χ2 là 1,0 (Hình 3). Cấu trúc dimer đến sự fit kém với giá trị χ2 là 10 và giá trị RG cao hơn là 38,7 Å và Dmax 140 Å so với giá trị RG thực nghiệm là 30,8 ± 0,7 Å và Dmax là 98 Å. Điều này chỉ ra rằng BSA tồn tại như một quần thể hỗn hợp của monomer và dimer.
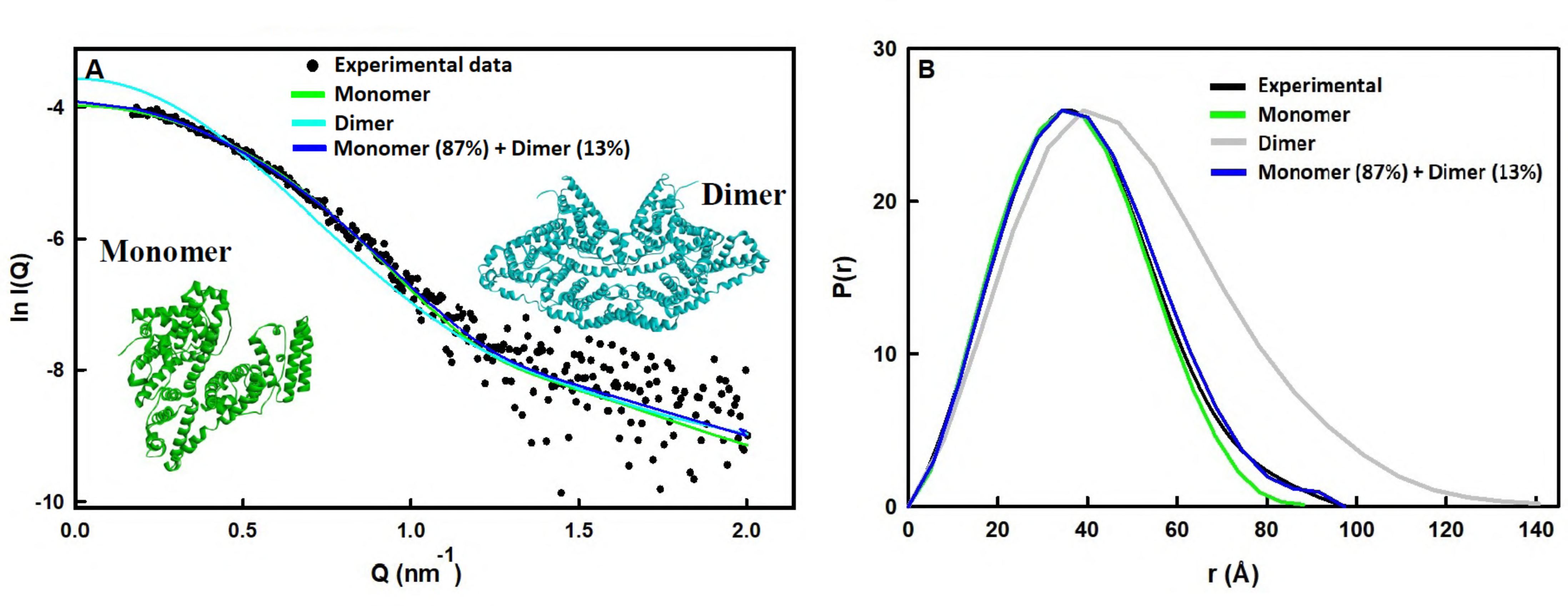
Fit đường cong SAXS của dữ liệu thực nghiệm (2,5 mg / ml) được phân tích bằng cách sử dụng mô hình các đường cong lý thuyết hợp nhất của monome và dimer cho kết quả tương đối tốt với χ2 là 0,8 và giá trị RG là 30,8 Å sử dụng trọng lượng tán xạ 87/13% ở pH 6,0 , tương tự với giá trị RG thực nghiệm (Hình 3). Các kết quả này cho thấy ở nồng độ protein thấp, tỷ lệ monomer và dimer là 6,7. Giá trị KD hằng số phân ly cho dimer được tính toán từ dữ liệu SAXS là 154 μM.
Kết luận
Hành vi của BSA trong dung dịch trên một loạt các nồng độ đã được nghiên cứu bằng cách sử dụng thiết bị phòng thí nghiệm Xeuss 3.0 SAXS/WAXS. Phân tích chi tiết dữ liệu SAXS kết hợp với fit đường cong mô hình tán xạ cho phép phát hiện chính xác tỷ lệ dimer BSA trong dung dịch. Những nghiên cứu này làm nổi bật rõ ràng ứng dụng tiềm năng của SAXS như một công cụ được thiết lập để thăm dò sự dimer hóa của protein và xác định hằng số phân ly đối với dimer protein.
Nguyễn Tiến Dũng tổng hợp và dịch
Nguồn: https://www.xenocs.com/characterization-of-protein-self-association/
Tìm hiểu thêm về thiết bị SAXS/WAXS của hãng Xenocs được sử dụng cho ứng dụng trên tại đây.
Tài liệu tham khảo:
[1] Rombouts, I.; Lagrain, B.; Scherf, K. A; Lambrecht, M.; Koehler, P.; Delcour, J. A. Sci. Rep. 2015, 5, 12210.[2] Karimi, M.; Bahrami, S.; Ravari, S. B., Zangabad, P. S.; Mirshekari, H.; Bozorgomid, M. Shahreza, S.; Sori, M.; Hamblin, M. R. Expert. Opin. Drug Deliv. 2016, 13, 1609–1623.
[3] Franke, D.; Petoukhov, M.V.; Konarev, P.V.; Panjkovich, A.; Tuukkanen, A.; Mertens, H. D. T.; Kikhney, A. G.; Hajizadeh, N. R.; Franklin, J. M.; Jeffries, C. M.; Svergun, D. I.. J. Appl. Cryst. 2017, 50, 1212–1225.
